採訪報導/郭家和
肺癌成臺灣新國病! 早期肺癌發生比例與風險因子
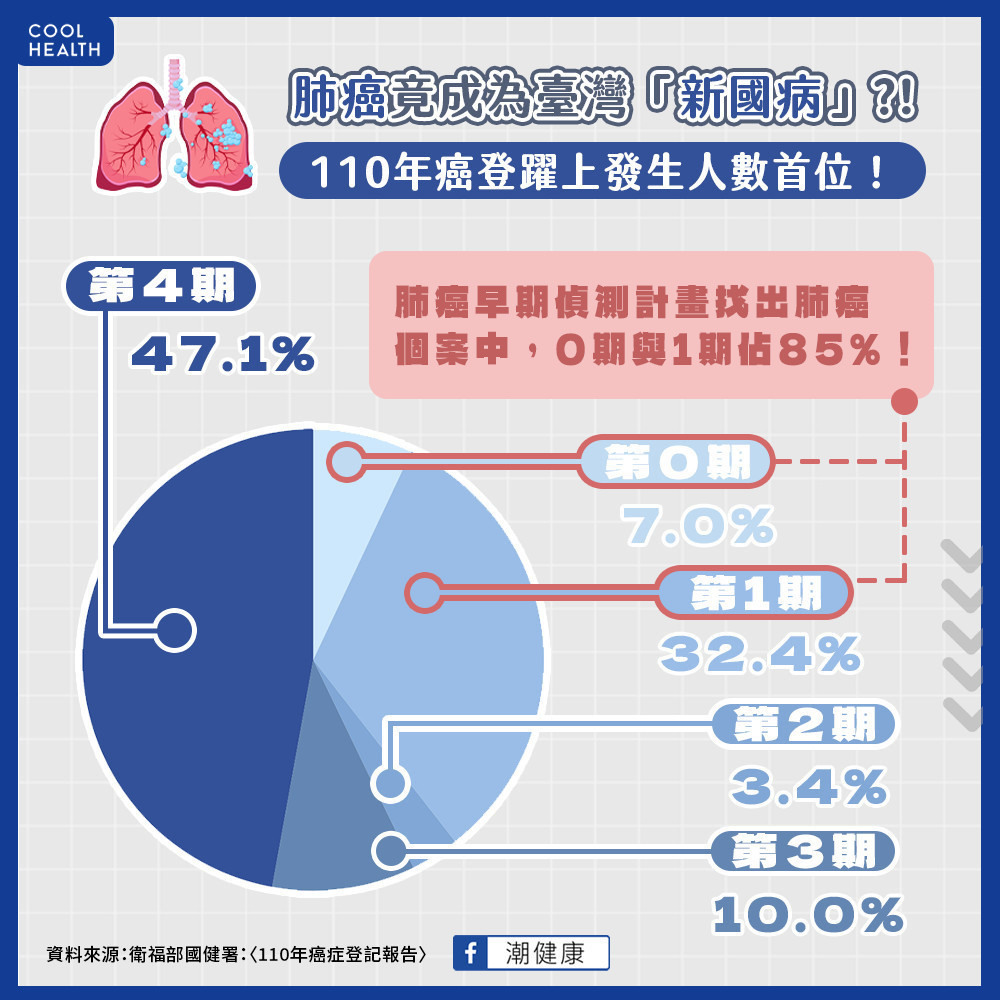
據111年十大癌症死因統計,肺癌一年造成10,053人死亡1
,死亡率高居十大癌症首位,且依最新110年癌症登記報告,肺癌發生率也一舉躍上首位,可謂為「臺灣新國病」。肺癌存活率與診斷期別相關,肺癌早期偵測計畫關篩檢找出的新增肺癌患者,有高達85%2屬於早期肺癌,在可預見的未來,初診斷肺癌期別為早期的比例會越來越高。然而,早期肺癌即使在手術切除後仍面臨不同程度復發風險,因此如何降低術後復發是目前及未來重要照顧早期肺癌病患的課題。
臺北醫學大學附設醫院胸腔內科蕭世欣主任表示,吸菸、肺結核病史、空污懸浮微粒、致癌物質如氡氣暴露等,皆為已知的肺癌風險因子,但不抽菸罹患肺癌:尤其是罹患肺腺癌的女性比例逐年增加,其背景原因尚未能明確解釋。在無法瞭解「不抽菸罹患肺癌」的關鍵原因之前,透過低劑量電腦斷層LDCT早期偵測肺癌、依據癌症期別及個人化檢測,採取對應的術後輔助治療,以降低復發風險,是改善肺癌整體存活的關鍵。
第2、3期患者3-6成恐2年內復發! 手術後輔助治療是早期肺癌預後關鍵之一
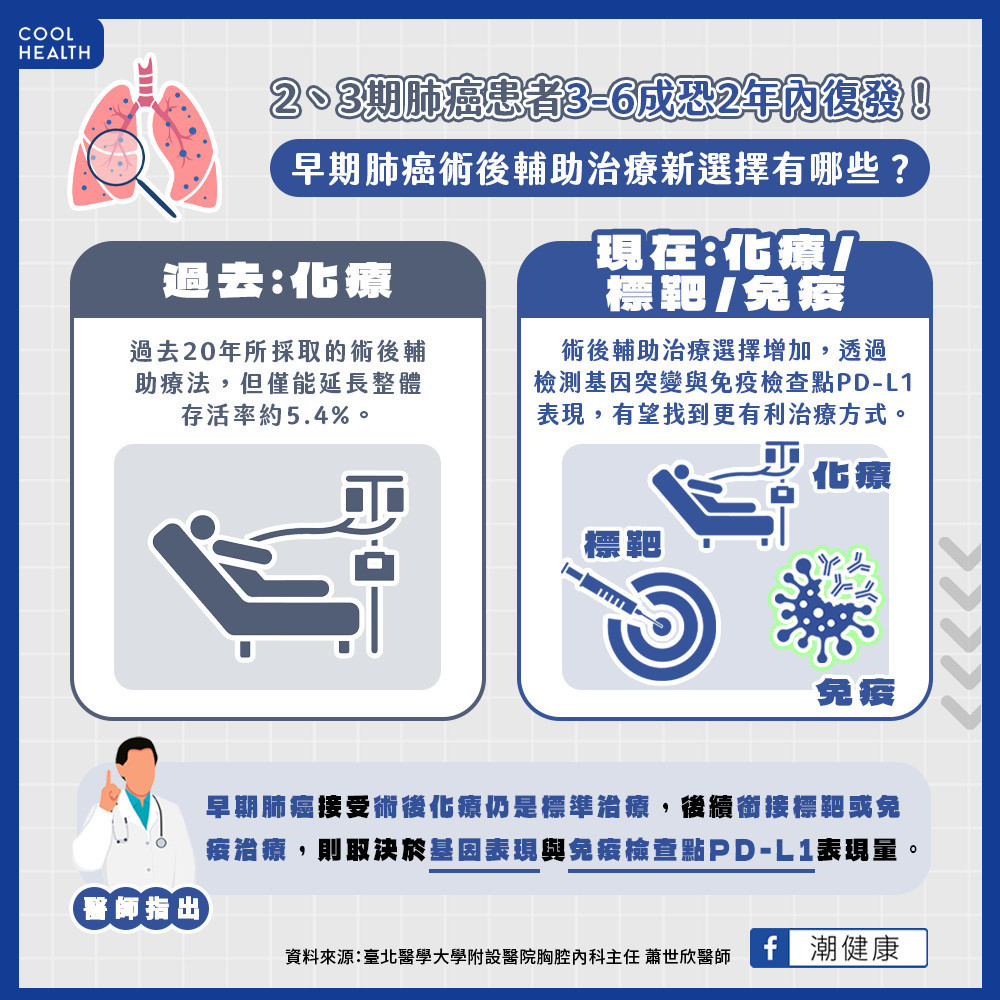
手術切除是治療早期肺癌的首要方式,然而蕭世欣醫師指出,即使從影像學判斷手術後病理報告顯示肺癌腫瘤已完整清除,仍可能有微量癌細胞在手術前或手術中流入血液或微循環中,跑到附近其他器官,造成後續手術後復發甚至轉移。早期肺癌復發率平均都有1到4成左右,其中第2期與第3A期更有30-60%,恐在2年內面臨復發風險3,且期別越往後者復發風險越高,預後愈不理想,只要屬於1B期以上的肺癌,都建議接受輔助治療。
蕭世欣醫師表示,為降低早期肺癌復發風險,過去二十年所採取的術後輔助標準治療是以化學治療為主,但僅能延長整體存活率約5.4%。近年肺癌標靶治療及免疫治療皆不斷進展,術後輔助治療的選擇增加,透過檢測基因突變與免疫檢查點表現,有機會找到更有利的輔助治療方式。
「目前為止,早期肺癌接受術後化療仍是標準治療,是否可以加入標靶治療或免疫治療,則取決於基因表現與免疫檢查點PD-L1表現量。通常PD-L1表現量愈高,免疫治療的好處愈大!」蕭世欣醫師建議,早期肺癌患者可提早與醫師討論是否檢測免疫檢查點PD-L1表現量,瞭解自身適合的輔助療法,為對抗肺癌長期戰線作好準備。

阻斷腫瘤剎車最佳可降55%復發率! 免疫治療PD-L1抑制劑助早期肺癌拚治癒
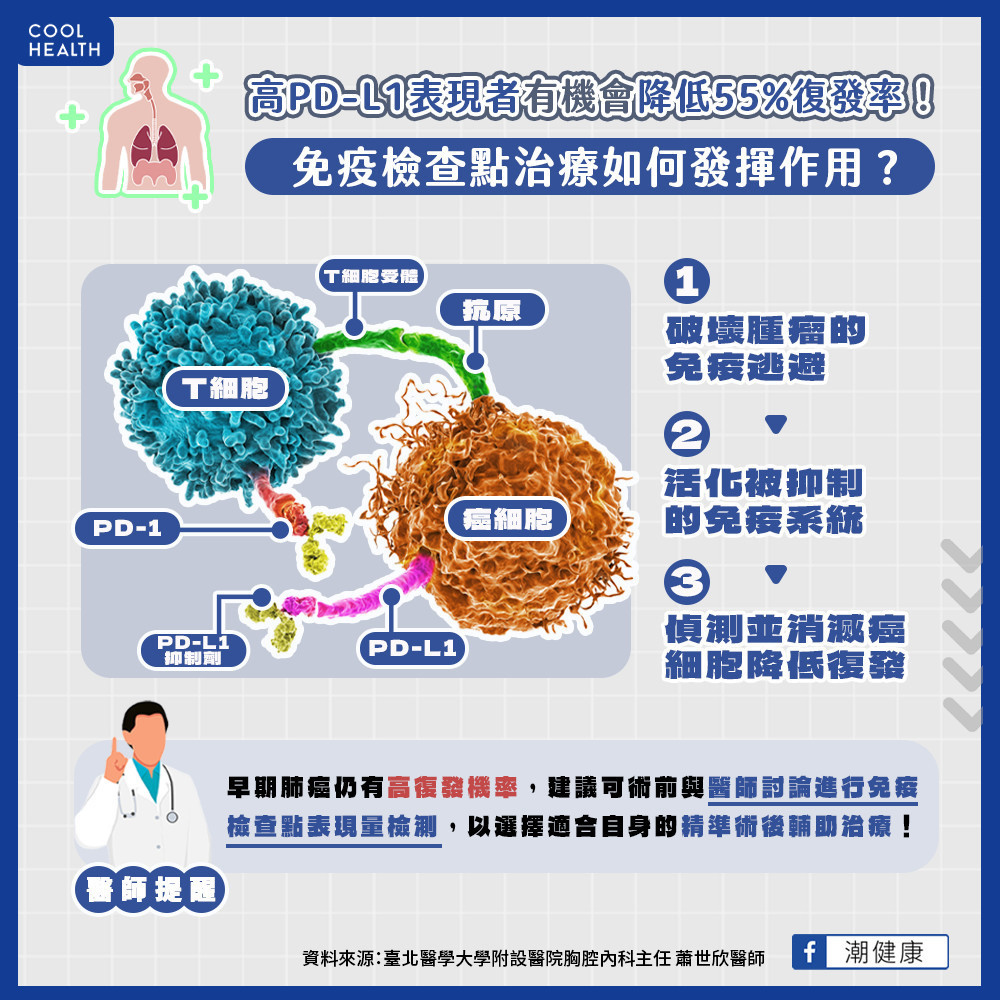
免疫治療為何能夠降低肺癌復發?蕭世欣醫師解釋,癌細胞會抑制人體免疫細胞調控,導致失去攻擊癌細胞的功能。免疫療法中的免疫檢查點PD-L1抑制劑,其可阻斷腫瘤踩住免疫系統的「剎車」,破壞腫瘤的免疫逃避、喚醒殺手T細胞,讓被抑制的免疫系統重新活化,得以偵測潛藏在體內極微量的癌細胞,將之殺除或抑制其不再增長,產生降低癌症復發的作用。
蕭世欣醫師指出,免疫治療從一開始用在第4期肺癌,現今在早期肺癌如第2期、甚至部份第3期肺癌亦證實其治療優勢。大型臨床試驗顯示,手術後接受標準輔助化療後再接受約1年的PD-L1抑制劑作為輔助治療,可幫助肺腫瘤具PD-L1表現的患者降低3成以上的復發率,而PD-L1高表現量的患者,更有機會降低復發風險5成5以上,突破過往早期肺癌輔助治療的治療瓶頸。
免疫檢查點PD-L1抑制劑是近年癌症治療的重要突破,美國癌症治療指引《NCCN》已將PD-L1抑制劑納入輔助治療指引中。蕭世欣醫師表示,無相關關鍵致癌基因突變的肺癌都在免疫治療的範疇內,新的臨床試驗證據問世,代表治療觀念應隨之更新,尤其第2期、第3期等早期肺癌接受精準輔助治療的效益,在肺癌高發生率的世代,將是防復發、拚治癒之利器。

未來肺癌5年存活率拚翻倍? 術前及早瞭解免疫PD-L1表現
「從健保資料庫來看,早期肺癌從過去10-20%,現在已佔所有肺癌30%以上,在低劑量電腦斷層等工具幫助之下,甚至可以找出『零期』肺癌!而臺灣的未來目標是肺癌的5年存活率翻倍,如何早期偵測、降低復發正是關鍵!」
蕭世欣醫師提醒,預防肺癌最重要的原則包括遠離已知風險,如抽菸、致癌物質暴露等,此外,平時應建立健康的生活習慣。符合高風險者或有家族史者,可依早期肺癌偵測計畫進行篩檢。一旦發現早期肺癌,可於手術前後諮詢醫師,以及早瞭解自身癌症基因與免疫檢查點表現量,與醫師討論最適合的精準輔助治療,擬定個人化的治療方針,將肺癌復發風險降到最低。

參考資料:
1. 見衛生福利部111年國人死因統計結果:https://www.mohw.gov.tw/cp-16-74869-html
2. 衛生福利部國民健康署〈肺癌篩檢5分鐘 還沒參加看過來〉:https://www.hpa.gov.tw/Pages/Detail.aspx?nodeid=4705&pid=173823. Stage II-IIIA (TNM 7th edition/select stage II-IIIB (TNM 8th edition);(1). Clinical cutoff: 21 January 2021. LR, locoregional. a Post-hoc descriptive analysis. Felip, et al. ESMO Presentation. 2021; (2). Hotta K, Matsuo K, Ueoka H, Kiura K, Tabata M, Tanimoto M. J Clin Oncol. 2004 Oct 1; 22(19):3852-9. (3). Sasaki, H., Suzuki, A., Tatematsu, T., Shitara, M., Hikosaka, Y., Okuda, K., Moriyama, S., Yano, M., & Fujii, Y. (2014). Prognosis of recurrent non-small cell lung cancer following complete resection. Oncology letters, 7(4), 1300–1304.
