
為了鞏固實證醫學的絕對價值,對於政策上既有的草率及不當,作者建議亡羊補牢:願意施打國產疫苗的人,應被視為臨床三期的志願受試者,以契約行為對待之,給予受試者合理的報酬,以及傷害補償(保險…)等,一切比照臨床三期辦理,作為未來申請藥證(法定文件)的依據。(圖/取自網路)
《前言》
這星期,全台灣的人不是在生病,就是在生氣,眾說紛紜,亂成一團。當權力不在人民手上的時候,再亂也束手無策,個人認為不妨靜下心來,想想何謂(生物)戰爭以及如何抗戰,比較實在。
那麼我們可以來釐清幾件事情:(1)定義抗戰的主軸是「防疫救人」;(2)戰略是找出敵人(普篩); (3)戰術是讓每個人落實避敵(疏散)、自救(疫苗)。這樣看事情,結論是人民一百分,政府零分。
我一個沒當過兵的女人家都知道如何抗戰,只有三軍統率不知道,在作戰一事上加了雜七雜八的烏龍戰術,例如政治可以抗疫(人家用的,我們不用…),拚生技產業與救急救人沒有優先順序(台諺:尿急才要挖茅廁),且要降格通過國產疫苗使用(唸了高中卻要授予大學文憑?),以及玩飢餓行銷(阻擋疫苗進口,留位子給國產疫苗),整個防疫步調因此失焦。
筆者深諳藥事法規科學以及國際上藥政法規揭櫫的普世價值,容我簡單介紹新藥產出的思維演進及管理趨勢。非醫學領域的人們在瞭解了「臨床試驗以實證醫學(evidence-based medicine,EBM)為依歸」的思維演進之後,對執政者想跳過臨床三期,將「試藥」當「藥」的不人道引發的全國大亂鬥,就有了邏輯判斷的基礎。
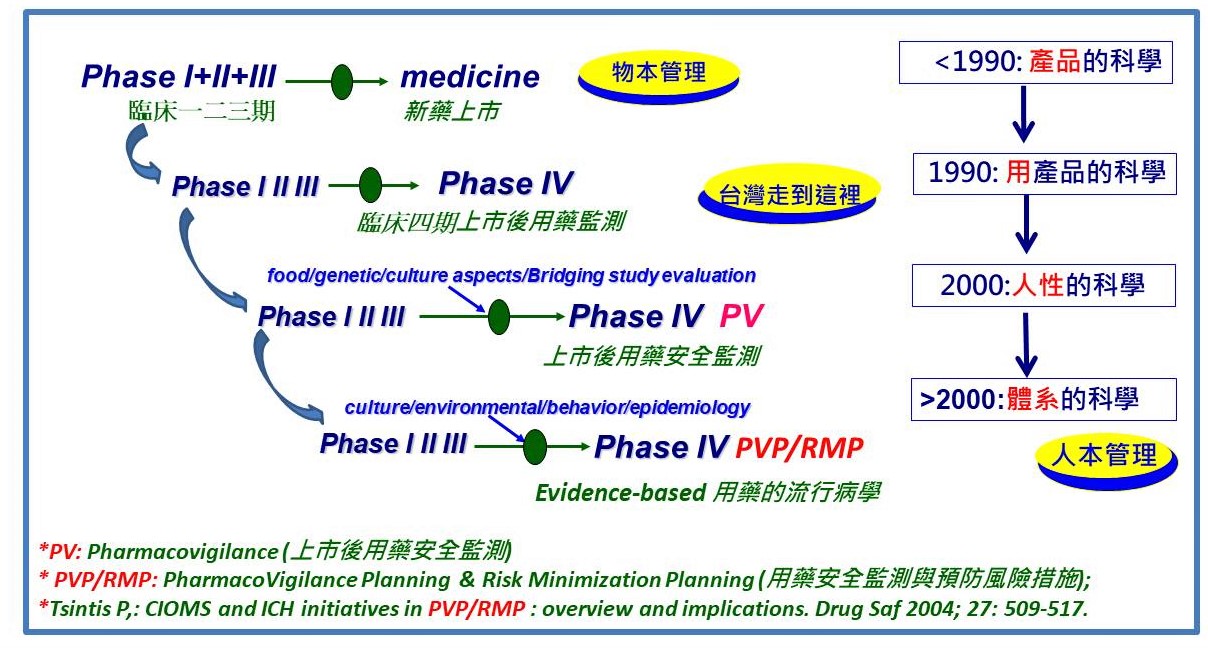 以十年為一期,ICH主導從「用藥」到「預防用藥風險」之程序正義及環境建構上的思維演進(圖/作者提供)。
以十年為一期,ICH主導從「用藥」到「預防用藥風險」之程序正義及環境建構上的思維演進(圖/作者提供)。
《救急救人第一》
食藥署於2020年10月公告了緊急授權使用國產疫苗辦法,國產疫苗只需做臨床二期,受試者三千人即可上陣使用。
也就是說,執政者擬在國產疫苗做完臨床二期後,就要推人民進戰場,上陣抗疫。這不是慈悲救國,是執政者有尚方寶劍(公費疫苗),用國家機器強迫人民參與生技發展的賭局,這不僅違背醫學/科學的主流價值,既不專業也不人道,同時向世人展示台灣將拿人民當白老鼠。

台灣已是開發國家,不可以做背離人道的事,再怎麼緊急也不能違背醫學/科學的主流價值,把人民當白老鼠。
對於政策的草率及不當,筆者建議的亡羊補牢做法是:願意施打國產疫苗的人,應被視為臨床三期的志願受試者,以契約行為對待之。意即擬提出緊急使用授權的單位應依照臨床試驗規範,以三期試驗的計畫書為依據,給予受試者合理的報酬、預防不可預知傷害的措施、以及傷害補償(保險…),取得受試同意書之後才施打試驗疫苗,並做安全監測,作為未來申請藥證(法定文件)的依據。
《國際藥政協合組織》
國際藥政協合組織(International Conference of Harmonization簡稱ICH)是由代表世界上80%藥品消費市場的美國、歐盟及日本所組成的藥政法規討論平臺,主導著「實證藥學」的思想演進(conceptual evolution),並據以制訂施政指引(guidance) ,從二十世紀通過臨床一、二及三期試驗即可上市藥品,演進到二十一世紀之臨床四期:藥品上市後之療效及安全性監測,以預防風險 (Pharmacovigilance Planning and Risk Minimization Planning,簡稱PVP/RMP)。
也就是說,隨著使用藥品的病人增加,療效及安全性(副作用、配伍禁忌等)數據須有微調的機制,用藥的流行病學也須從小數據到大數據,做實證藥學再評估。
用藥沒有國界,ICH每二年在Washington DC召開研討會,成為藥政法規與管理的標竿,吸引幾萬個代表各國政府、學術界、醫療院所、藥廠以及第三方機構(保險等)的專家參與。我國藥政單位編列幾百萬預算,委由受託執行新藥申請的「醫藥品查驗中心」(CDE)派員與會,俾在新藥審查上與時俱進,接軌國際,幾十年來已培養不少前端審查的專家,結果再交由食藥署的「藥品審議委員會」進行審批。
如此嚴謹的SOP已行之有年,筆者才會在總統及前副總統公開為二期臨床試驗的國產疫苗背書時,跳出來嗆聲:難道專業都向總統繳械了嗎?
《實證醫學》
實證醫(藥)學這個詞太有梗了。舉凡觸及醫學領域的,例如新藥(疫苗)研發、臨床試驗、審批、智財權(專利、商業機密或資訊公共財分際…)、市場秩序及價格(健保、計價)、國際貿易的法規橋接、甚至犯罪層面的管理等,皆以「實證醫學」為依歸。
於是「medicine」的定義已從「藥是產品」的概念進化到「藥是知識經濟型產品」,簡單的說,「藥」指的是「藥+仿單(說明書)。這張「仿單」太重要了,包含著管理上述所有實證醫學層面的知識證據。這個認知應該融入人民的基本常識之中,才能保障人權不被侵犯。
《以實證醫學談臨床試驗》
科學上,數千到數萬人的臨床試驗數據,讓外來物質(試藥)變成「新藥」。有幾分證據說幾分話,那麼,臨床「一+二」期的證據,與「一+二+三」期的證據不會一樣。新藥上市後,治療數百萬甚至數億病人的用藥數據,與藥品申請上市時的數據也不會一樣。所以藥的數據是個浮動的證據,對吧?沒有人可以推翻法定的「一+二+三+四」期臨床試驗四部曲。

用藥政策不可背離實證醫學的人道精神。
那麼,為什麼目前新冠肺炎疫苗都還沒有拿到藥品許可證?因為核證一事茲事體大,如上所述,許可證是個牽涉多層面管理的法律檔,要等官方發給許可證,緩不濟急,所以在有了完整的臨床三期資料,並通過審批後,以臨床醫學科學證據提出緊急授權使用(EUA),我國也早有此管道。
我國每年申請臨床試驗許可的案件不下數百件,申請人是執行臨床試驗的醫院(病人的代表人)。完成臨床試驗後申請新藥許可證的也有數十到百件,申請人是藥商(許可證的擁有者)。疫苗是新藥的一種,執政者不許民間申請,侵犯了人民(個人、法人)申請用藥的權利。台灣何時變成政治凌駕專業管理的極權統治了?
《結語》
用藥像摸黑走路,看不見危險。這個執政黨在病毒空襲的生物戰中,連犯了兩個重大的戰略錯誤,以極權式障礙阻擋民間進口可立刻救急的疫苗,再用國家機器(公費疫苗)要人民施打跳過臨床三期的國產疫苗。二十一世紀了,追求社會公平正義須行之以道,才是慈悲,才合乎人道,道理再簡單不過。

作者簡介
王惠珀,台灣桃園人,台大藥學院學士、美國密西根大學藥學博士。曾任台大醫學院藥學院(系)教授及系主任、長庚大學醫學院天然藥物研究所創所所長、台北醫學大學藥學院長、行政院衛生署藥政處處長等職。專長涵蓋新藥設計開發及藥事管理。
其新藥研究曾獲十五國四十一項發明專利,及獲頒經濟部「國家發明獎」等多項發明與研究貢獻獎,並列名當代名人錄及國際年度專業人士。
王惠珀在藥政管理上致力於以智財權管理藥品之學名藥立法、推動優良藥品製造規範等,以及促成健保藥價「三同政策」。此外並曾開啟專業橋接庶民的「全民用藥教育」計畫、「人民的眼睛」計畫,蓄積藥師參與社區公共衛生及長期照護的能量,獲得行政院「參與及建立制度獎」、藥師典範獎。