【NOW健康 陳曉彤/台北報導】食品藥物管理署表示,為確保國人使用藥品之品質、有效與安全,所有藥品在上市前皆須經食藥署嚴格審查其安全、療效及品質等科學性資料,確認療效大於潛在風險,以及製造廠GMP狀態,始核發藥品許可證。藥品上市後源頭原料藥及製劑之製造須符合GMP規範,藥品出廠前要逐批檢驗確認符合規格,出廠後之運銷作業亦須符合GDP(Good Distribution Practice)優良運銷規範,並以持續安定性試驗監控效期內藥品之品質。

▲關於上市前藥品把關機制,需確認製造廠能力、確保產品製造品質一致性。(圖/食藥署提供)
國內239家製藥廠通過GMP認證 抽檢合格率高達9成
我國推動藥廠實施GMP已逾40年,食藥署於102年成為PIC/S組織成員,採用國際認可之PIC/S GMP標準,使我國藥品品質保證策略,從透過品質管控方式,進化為以嚴謹之製藥品質系統要求藥廠作業需全方面符合PIC/S GMP之規定。截至113年3月,我國已有239家製藥廠(含製劑、原料藥、醫用氣體及物流等)符合PIC/S GMP,食藥署亦依藥廠生產產品之劑型、作業內容及歷次檢查紀錄,每2至4年執行後續查核及不定期查核,透過穩健之PIC/S GMP查核體系持續確認製藥品質系統運作之穩定及一致性。

▲食藥署表示,截至113年3月,我國已有239家製藥廠符合PIC/S GMP。(圖/食藥署提供)
國內建立之藥品GMP查核體系 受歐盟各國主管機關信賴
食藥署表示,國內建立之藥品GMP查核體系,已深受各國主管機關信賴,如澳洲TGA等10個國家主管機關採直接認可食藥署之查核結果,美國FDA等PIC/S會員透過PIC/S組織平台分享藥廠稽查報告及查核資訊,得免除來台查廠。此外,食藥署亦於112年被正式列入歐盟公告之輸歐原料藥第3國名單,我國原料藥外銷歐盟可免除隨貨逐批檢附原料藥品質與歐盟GMP相當之書面證明文件(即Written Confirmation),肯定我國原料藥管理制度與歐盟相當,顯見我國稽查水準已獲國際認可。
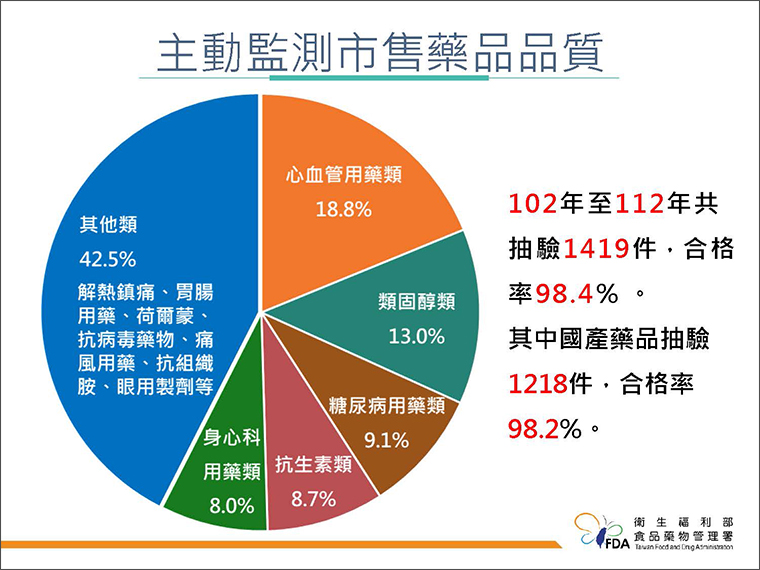
▲食藥署監測市售藥品品質,102年至112年共抽驗市售藥品1,419件,合格率98.4%。(圖/食藥署提供)
食藥署強調,為強化上市後藥品管理,建有主動及被動之藥品上市後品質監測機制。每年依據藥品管理需求,執行市售藥品品質監測,102年至112年共抽驗市售藥品1,419件,合格率98.4%,其中國產藥品抽驗1,218件,合格率98.2%,透過多元機制全面確保國人用藥品質。

▲食藥署指出,102年至112年上市藥品抽驗合格率高達9成以上。(圖/食藥署提供)
# 首圖來源/Freepik
更多NOW健康報導
▸【下班聊健康】妹妹癢怎麼辦?女人該懂的私密處保養
▸全身麻醉後卻像鬼壓床? 醫師強調肌肉張力監測重要性
就❤NOW健康:社群 │ 影音 │ 官網 │ 醫級邦 │ 健康安妞 Podcast