文/郭家和
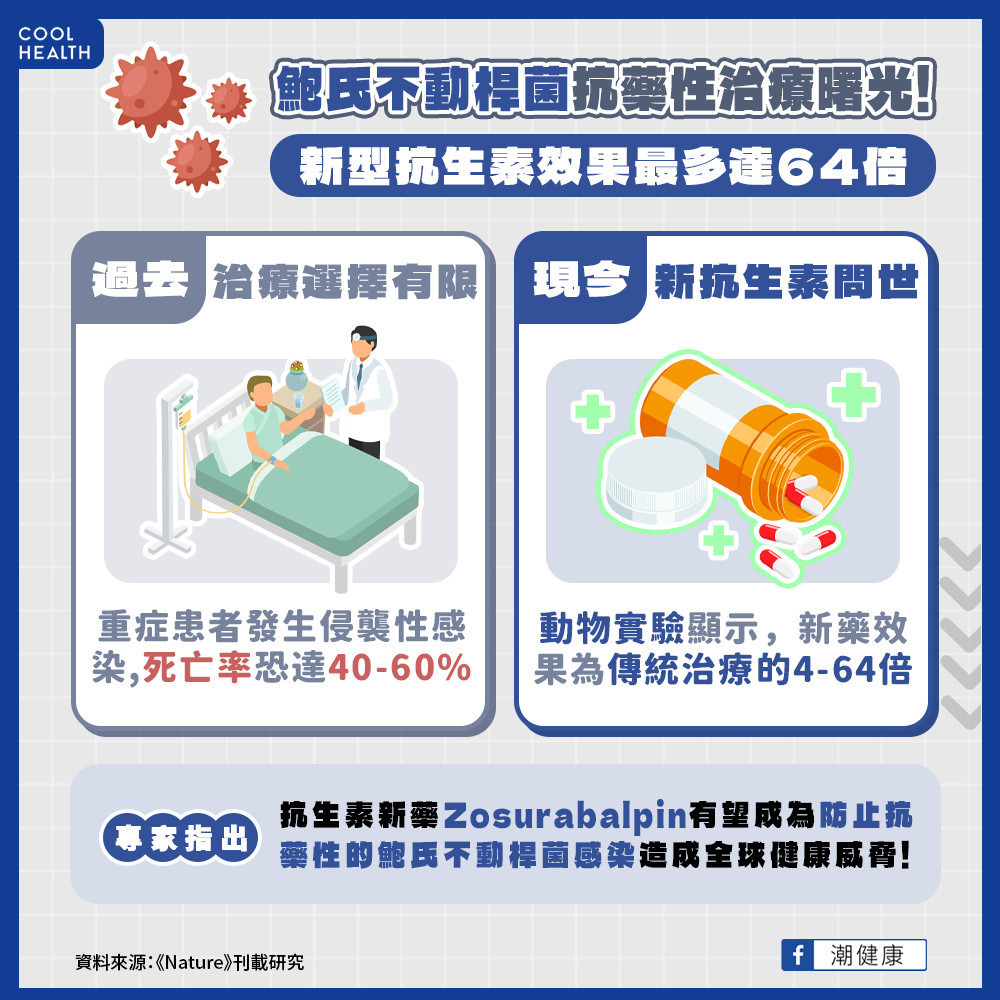
鮑氏不動桿菌抗藥性曙光! 新型抗生素效果達4-64倍
抗生素抗藥性的增加已成為全球公共衛生重要議題,其中,屬於革蘭氏陰性菌的「鮑氏不動桿菌」(Acinetobacter
baumannii,又稱為AB菌)是造成院內感染高致死率的重大威脅,被視為最重要的「伺機性致病菌」(opportunistic
pathogens)。對碳青黴烯類(carbapenem)抗生素具有抗藥性的「碳青黴烯類抗藥性鮑氏不動桿菌」(CRAB)過去治療選擇有限,住院或重症患者一旦發生侵襲性的CRAB感染死亡率可能高達40%-60%。
在國際權威期刊《Nature》最新研究論文中,為研發治療碳青黴烯類抗藥性鮑氏不動桿菌感染的新型抗生素藥物,哈佛大學化學暨化生系、生化暨分子藥學系與瑞士羅氏藥廠共同研發的抗生素Zosurabalpin(RG6006),透過高速篩選從近4萬5千個大環胜肽類化合物中找出可能有效的生物活性物質(hit),發現3個專屬胺基酸序列,再經實驗室架橋環化(MCP
lead)及最佳化(optimized
candidate),構成新的大環內硫醚類抗生素。
試驗顯示,Zosurabalpin用於免疫不全且感染碳青黴烯類抗藥性鮑氏不動桿菌的小鼠身上效果為傳統治療的4-64倍,其安全性與存活率相當優異,預計很快進入臨床一期試驗。有望成為防止侵襲性、抗藥性的鮑氏不動桿菌感染造成的全球健康威脅。
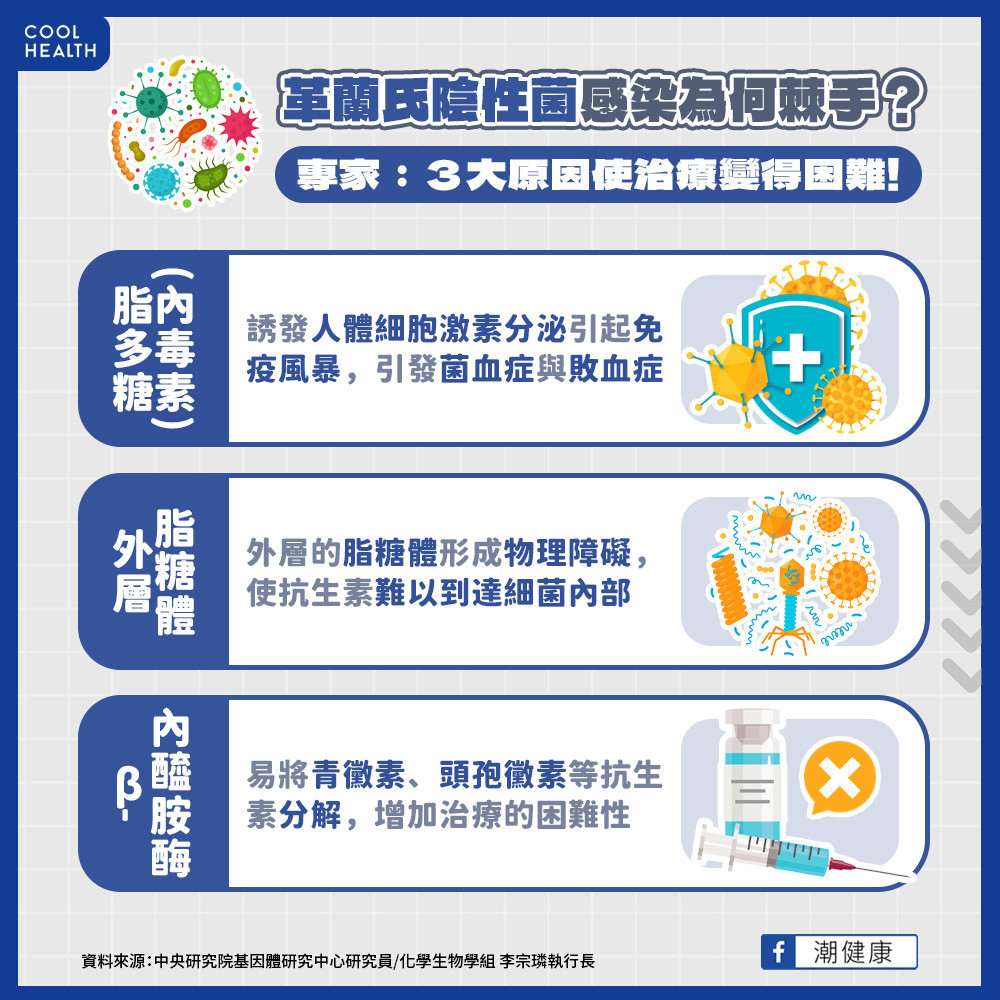
內毒素易誘發免疫風暴致死 新型抗生素突破治療困難
中央研究院基因體研究中心研究員、化學生物學組執行長李宗璘接受採訪說明,經常造成感染的革蘭氏陰性菌包括大腸桿菌、克雷白氏菌、綠膿桿菌以及鮑氏不動桿菌。革蘭氏陰性菌的細胞壁外膜主要為脂多糖(LPS)層,脂多糖亦被稱為「內毒素」,會誘發人體細胞激素分泌引發免疫風暴,若治療無效甚至引發菌血症與敗血症造成患者死亡。由於革蘭氏陰性菌外層的脂糖體形成物理障礙,使抗生素難以到達細菌內部。
李宗璘研究員表示,鮑氏不動桿菌通常帶有b-內醯胺酶(b-lactamases)將青黴素、頭孢黴素等抗生素分解,增加治療的困難性。該研究找出的新的半合成化合物,透過架橋形成大環內硫醚抗生素作用於脂糖體的穿膜輸送器複合體,成功使過去被認為「不可成藥」標的(undruggable
target)變成藥物標的(drugable
target),並以冷凍電子顯微鏡解析出輸送器-脂多糖-大環內硫醚三元復合物結構(LptB2FG-LPS-MCP)確認其結合位置,活體內、活體外及安全性實驗已確認具有候選藥物的效果。在新型抗生素開發上可謂是一大突破。
不過,李宗璘研究員指出,抗生素分為「寬光譜」及「窄光譜」,該研究的大環內硫醚類抗生素的靶點只針對鮑氏不動桿菌有效,屬於「窄光譜」型,對其他革蘭氏陰性大腸桿菌、克雷白氏菌、綠膿桿菌等無效,因此需針對其各別的脂糖體輸送器經進一步的實驗找出對各自輸送器專一的先導化合物(lead
compound),新藥的發現及發展從超高速篩選系統(uHTS)到近年的電腦或AI輔助設計、藥標物的虛擬篩選、細胞表型篩選等,已能夠更快速有效的設計或發現對標物(drug
target)的生物活性物質,幫助科學家加速找到新藥研發方向。
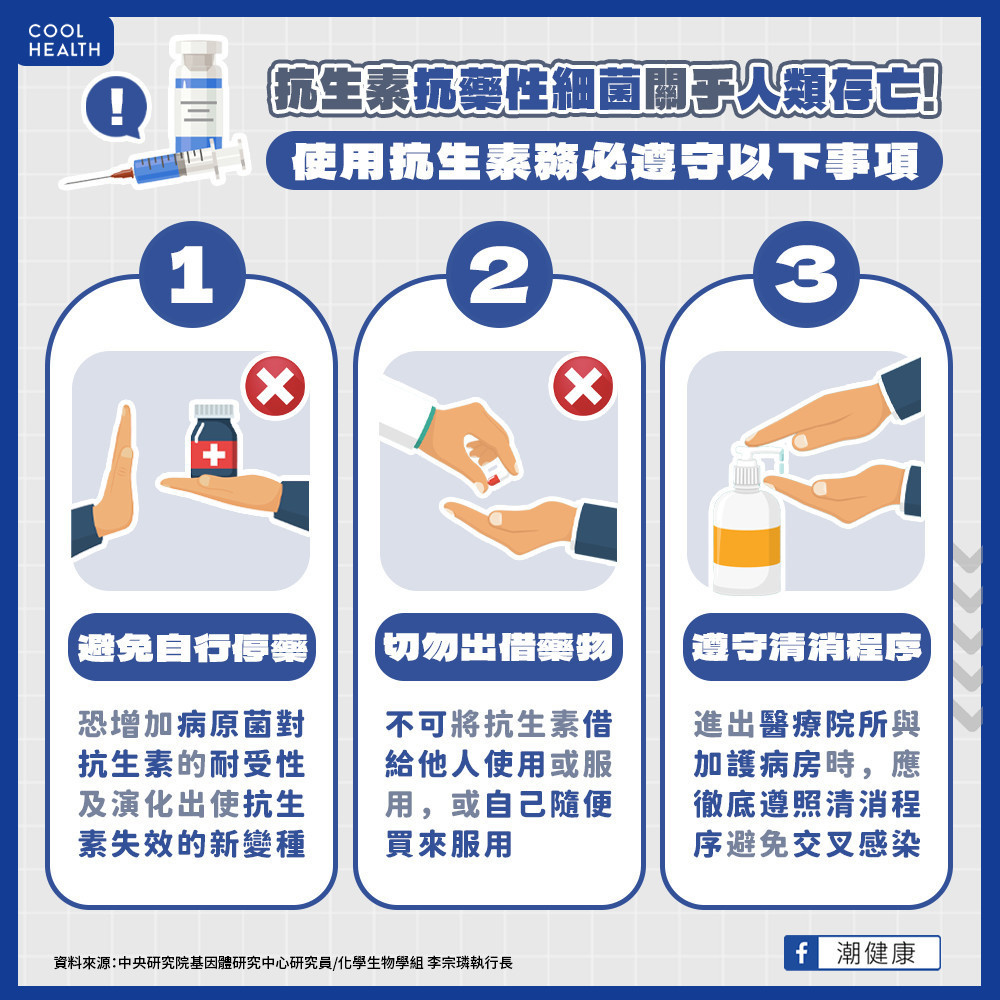
抗生素抗藥性年致死將達千萬人 切勿濫用、誤用抗生素
抗生素抗藥性對人類健康的威脅不容小覷,聯合國環境規劃署(UNEP)預估2050年時,每年將有1千萬人因抗生素抗藥性死亡。李宗璘研究員表示,抗生素抗藥性可能導致院內發生侵襲性感染時無藥可用,開發新抗生素緩解抗生素抗藥性問題刻不容緩,而開發新藥化合物耗資巨大,許多藥廠無意投資收益較低的抗生素類藥物,大多以原先抗生素化學結構重新修飾改良。新型態抗生素的開發仍須政府單位提供租稅優惠或獎勵,增加業者誘因,才有助於開發新藥的推動。
李宗璘研究員提醒,抗生素抗藥性與多重抗藥性細菌關乎人類的存續,病原體與人類共存競爭後極可能演化出「超級細菌」威脅全球。一般民眾使用抗生素務必依照醫囑,不可將抗生素借給他人使用或隨便自己買來服用,也不可以隨意自行停藥,會增加病原菌對抗生素的耐受性及演化出使抗生素失效的新變種。病原體之抗藥性多為垂直子代傳遞或是水平基因轉移,需要進出醫療院所與加護病房時,應徹底遵照清消程序避免交叉感染來幫助細菌產生抗藥性問題。
資料來源:
A novel antibiotic class targeting the lipopolysaccharide transporter
