(中央社訊息服務20231127 15:07:51)近年國際間生技藥品、細胞與基因治療產品及核酸藥物等先進醫療產品隨著技術突破與治療精準化需求增加而迅速的蓬勃發展。我國在精準健康、創新生物相關技術上亦取得相當進展,然而產業發展的同時,亦有許多法規議題需要持續調和。
據此,今(112)年資策會科技法律研究所以精準健康和創新生物法制議題為主軸,主辦多場專家座談會交流各領域的看法意見,亦於8月16日舉辦「精準健康法制研討會」、9月18日舉辦「創新生物產業前瞻法制趨勢研討會」,邀集產、官、研、醫領域專家分享經驗,藉以匯聚產業界共識,為產業發展鋪出新路。今年度之重點成果如下:
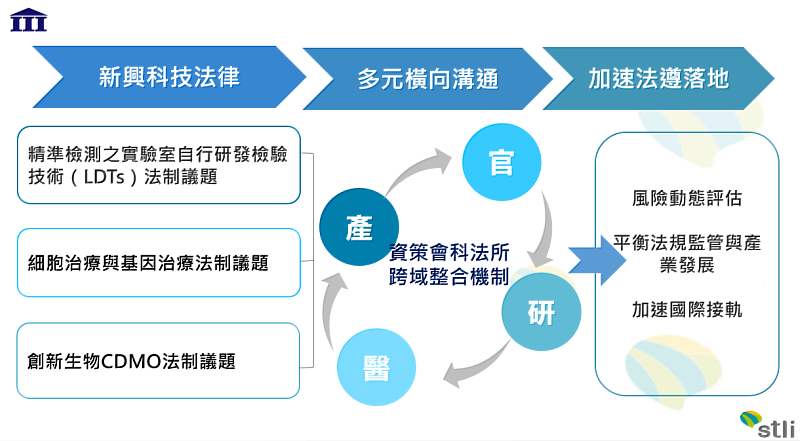
1.精準檢測之實驗室自行研發檢驗技術(LDTs)議題:業界齊支持醫療機構委託之LDTs實驗室在115年之後能持續採用多元認證,包括像是美國病理學會CAP國際認證、ISO 15189、台灣病理學會認證等,多元認證能與國際有相同的標準,有助於產業界加速接軌國際。而LDTs的案件審查,衛福部也已進行多項的優化調整。盼持續透過多元的溝通平台,從多面向推動與橫向的跨部會溝通,攜手各界完善LDTs法制環境,加速與國際接軌。
2.再生醫療議題:台灣的細胞與基因治療商業模式已逐漸形成,法規方面《再生醫療法》及《再生醫療製劑條例》雙法草案雖然已經在今年2月送立法院審議,但各界仍需要更多的共識,需等待下次立法院會期再審議。核酸藥物方面,政府積極投入資源催生相關產業鏈成形,惟人才、法規等面向資源與經驗不足,台灣需要延攬更多有產業經驗的核酸藥物專家資源,以形成支持核酸療法產業發展的生態系。
3.創新生物CDMO議題:近年對於先進醫療產品需求增加,CDMO產業也持續飛速成長,許多CDMO公司也投入研發資源以突顯其特色,或透過收購擁有特殊技術的CRO公司來加速藥物開發進程,除了創新研發,我國也於2022年將CDMO公司納入《生技醫藥產業發展條例》租稅優惠範疇,以加速建構創新生物產業發展之環境,但法規與實務執行之落差仍需滾動的溝通調整,讓業者掌握最新趨勢與相關法規要點,同時鞏固業務和開拓商機,才能達到獎勵業者之實質效益。
隨著科技發展,ICT與BIO開始交互串接,業者也期待法規的監管能與產業需求平衡發展,而法律衡量的重點是如何將風險降到最低,但風險是動態的,非單一層面的問題,這也是科技法律形成最困難的地方,因此科法所將持續透過多元方式傳達業界聲音,並進行跨部會溝通,來引導加速新興科技法規優化,促成產業、醫療機構及病人三贏之局面。
【資策會科技法律研究所官網】 https://stli.iii.org.tw/
【新聞聯絡人】 資策會科法所 顏翩翩 Tel: (02) 6631-1084 Email: [email protected]