攝護腺癌是男性的第5大癌症,平均每年有5千多人罹病、1千多人死亡,而其中最可怕的就是產生抗藥性「去勢抗性攝護腺癌」。但國家衛生研究院生技與藥物研究所王鴻俊助研究員發現,只要透過調控癌細胞的代謝機制,其實就可以有效抑制腫瘤生長,跟今年諾貝爾獎的機制有異曲同工之妙。
攝護腺癌的療法有哪些?
雖然「攝護腺癌」是男性專有的癌症,但跟大腸直腸癌很像,只要還能接受手術切除,有80~90%能安全通過5年存活率,但只要過了可以手術切除的時候,治療起來都非常困難。

圖說/國衛院生技與藥物研究所王鴻俊助研究員。
除了手術切除之外,攝護腺癌還有放射線治療、冷凍治療、去勢治療(包含手術去勢及荷爾蒙治療)、化學治療、標靶藥物等。但這些治療方法,除了去勢治療之外,效果都很有限,即使是去勢治療,也只能「控制癌症的範圍」,而且多半在治療1年多之後就會復發。
攝護腺癌的去勢療法
攝護腺癌跟一般癌症不一樣的是,癌細胞的生長與轉移是受到雄性激素(androgen)所控制,所以所謂的「去勢療法」,就是抑制雄激素的分泌或表現,包含睪丸切除及注射、口服荷爾蒙藥物等方法,但同時會造成性功能障礙,所以稱為「去勢」。
不過,在接受1~2年的去勢療法之後,攝護腺的癌細胞會逐漸適應環境,變成不再需要雄性激素就能存活,稱為「去勢抗性攝護腺癌」,等於是復發的狀態,接下來可能就只能接受化療、延長幾個月的壽命,無法可治。
諾貝爾獎的癌症代謝法
而2019諾貝爾醫學獎抗癌新招:「別讓你的癌症腫瘤『缺氧』!」其實代表現在的癌症治療,已經從「拿大砲去打仗」,進入到「切斷糧食運輸」的作法,透過細胞本身的代謝過程,從源頭去堵死不正常生長的腫瘤,而身體本身付出的代價是更小的。
王鴻俊就跟台北醫學大學龔行健院士合作研究,分析去勢抗性攝護腺癌細胞,結果發現,在細胞內有一個KDM8(組蛋白去甲基酶)的蛋白特別活躍,也讓負責從身體抓足夠的葡萄糖給癌細胞吃的代謝激素「PKM2」(丙酮酸激酶)特別活躍,所以,只要抑制KDM8,其實等於「讓癌細胞沒飯吃」,自然就餓死了。
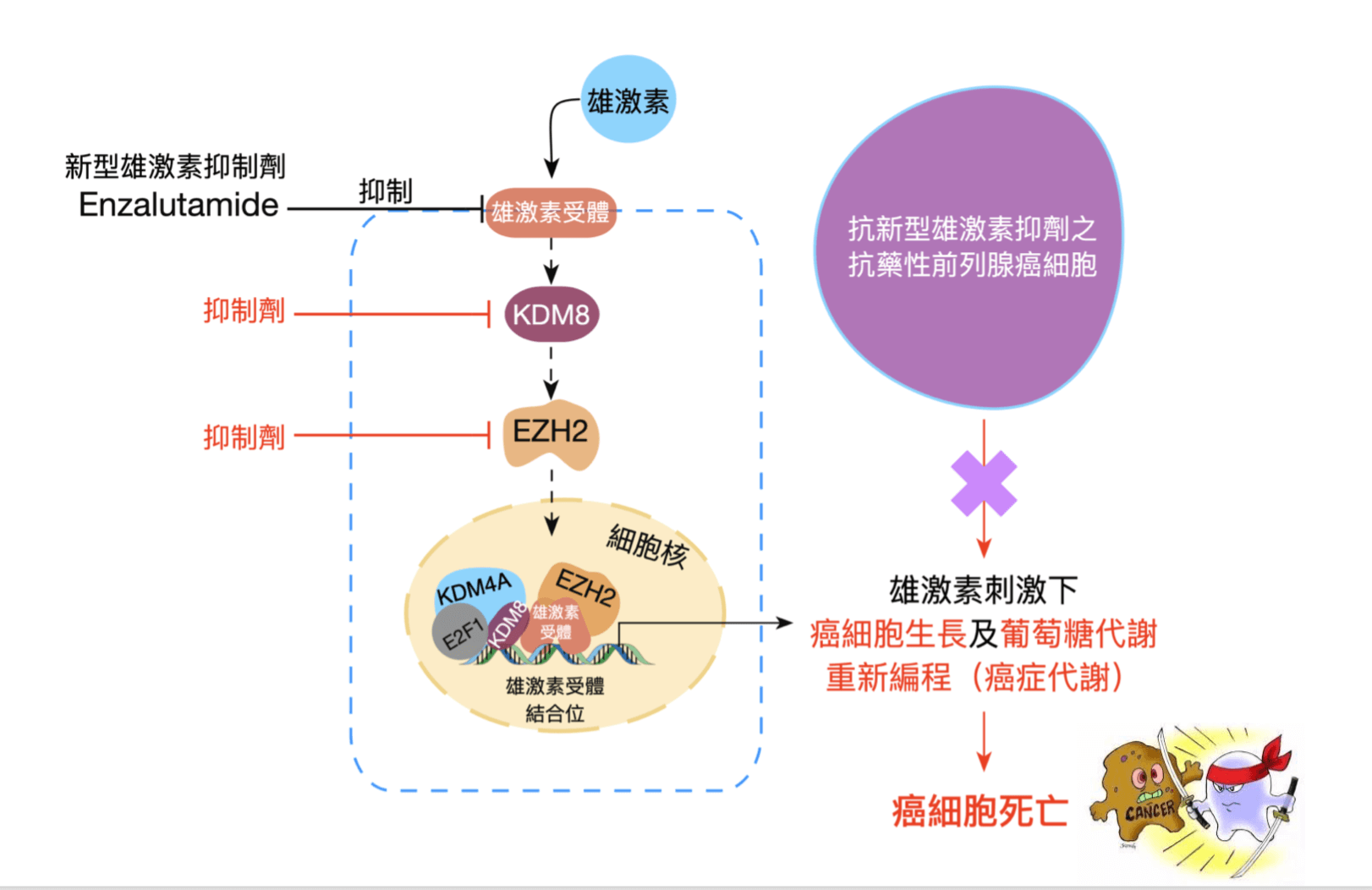
這也是全世界第一次發現,可以透過KDM8來抑制攝護腺癌細胞代謝。而團隊也同時抑制了多種癌症的相關基因EZH2,也發現抑制EZH2也能抑制抗藥性的產生。王鴻俊說,「如果同時抑制EZH2跟KDM8,可以預期抗藥性會減低很多,甚至是更好的治療選擇,在小鼠實驗中,光是抑制KDM8就已經消滅了80%的腫瘤。」
而抑制EZH2可以抑制多種癌症,所以相關的抑制劑研究已經了很多,對付攝護腺癌,只需要再一個「KDM8抑制劑」。王鴻俊說,目前實驗室也很努力的研究KDM8抑制劑,可以預期在5~10年間會有新藥面世,配合EZH2的抑制劑,治療去勢抗性攝護腺癌也不再是夢。
>> 加入 Heho健康 LINE@ 好友,健康知識不錯過!
延伸閱讀
健康是最好父親節的禮物 2c.c.血液檢查讓攝護腺癌現形
第一次健康檢查該做什麼?一張表告訴你這些項目必做
文/盧映慈 圖/何宜庭